Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
EINLEITUNG
Von Robert Wilhelm Bunsen (dem Entwickler des Bunsenbrenners) erzählt man sich folgende Geschichte:
Als er mit einem Freund in einem Restaurant essen ging, gab es Hähnchen. Sobald sie fertig waren, zückte er aus der Manteltasche ein Fläschchen und streute Lithiumchlorid über die eben abgenagten Knochen. Am nächsten Tag gingen sie wieder dorthin - es gab Hühnersuppe. Er tauchte einen Platindraht in die Suppe und hielt diesen in die Flamme eines Spiritusbrenners. Diese verfärbte sich rot, wodurch er nachgewiesen hatte, dass die abgenagten Knochen des Vortages für die Suppe verwendet wurden!
SCHWIERIGKEITSGRAD
Schülerversuch - einfach
GERÄTE
Bunsenbrenner, Magnesiastäbchen, Feuerzeug, 2x 50 mL Becherglas, 5-6 Uhrglasschälchen, Spatel.
CHEMIKALIEN
verd. 10% Salzsäure
Natriumchlorid
Kaliumchlorid
Lithiumchlorid
Calciumchlorid
Bariumchlorid
Kupfersulfat
DURCHFÜHRUNG
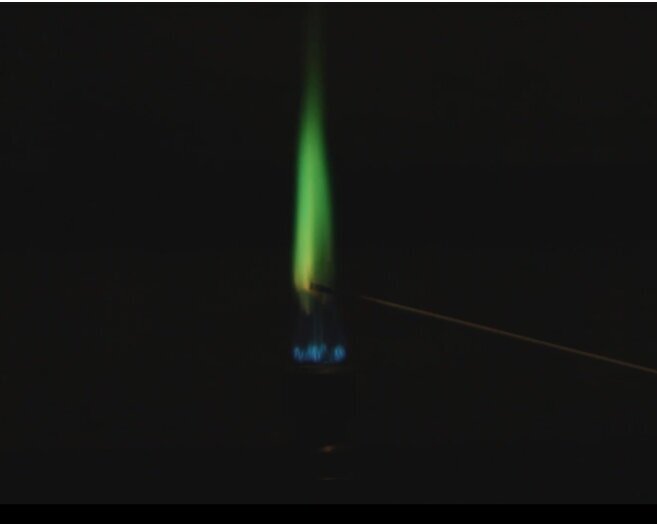
In jedes der Uhrgläser kommt ein Spatel des entsprechenden Salzes. Ein Magnesiastäbchen, welches zuvor ausgeglüht wurde, wird in dest. Wasser getaucht und damit eine kleine Menge eines beliebigen Salzes aufgenommen und in die nicht leuchtende Brennerflamme gehalten.
Danach reinigt man das Stäbchen durch Eintauchen in Wasser, dann Salzsäure, dann erneut Wasser, bevor ein anderes Salz getestet wird.
ANMERKUNG
Die Magnesiastäbchen sollten nur an einem Ende angefasst werden. Natriumionen durch Schweiß auf der Haut, sorgen für eine schwer zu entfernende, alles überdeckende, gelbe Flamme. Das anfängliche Ausglühen würde sich dadurch auf mehrere Minuten erstrecken.
Substituiert man giftiges Bariumchlorid mit verträglicherem Kupfersulfat, ist der Versuch als Schülerversuch durchführbar.
ENTSORGUNG
Kupfersulfat und Bariumchlorid (sowie alle Waschlösungen bei Verwendung dieser beiden Stoffe), kommen in den Behälter für anorganische Schwermetallsalze.
Die übrigen Salze werden gut verdünnt über den Ausguss entsorgt. Nicht kontaminierte Salzsäure wird vorhergehend mit Natriumcarbonat neutralisiert (starke Gasentwicklung!).
ERKLÄRUNG
Zur Erklärung kann man das Bohr'sche Atommodell heranziehen (wobei streng genommen nur das Wasserstoffspektrum damit erklärt werden kann): Demnach kreisen die Elektronen auf definierten Bahnen um den Atomkern.
Wenn wir Energie in Form von Wärme hinzufügen, gehen die Elektronen in einen angeregten Zustand über und wechseln in eine äußere Schale. Beim zurückspringen in den Grundzustand, wird diese Energie wieder in Form von Licht frei, wobei die Wellenlänge (und dadurch die Farbe) vom Energiebetrag und dadurch von der Differenz der Energien des höheren und des niedrigeren Energiezustands abhängt.
Betrachtet man dieses Licht durch ein Spektrometer, werden die einzelnen Spektrallinien sichtbar. Diese, sowie deren Verteilung, ist für jedes Element charakteristisch und dient als Nachweismethode. Die Existenz von Indium wurde erstmalig durch die indigoblaue Spektrallinie nachgewiesen (nach der das Element auch benannt wurde).
Die Spektrallienen der meisten Elemente liegen allerdings nicht im sichtbaren Bereich des Lichts: Magnesium emittiert unter anderem im UV-Bereich. Daher können wir beim dem Versuch Stäbchen aus Magnesiumoxid verwenden, ohne dass eine störende Färbung auftritt. Außerdem ist das Emittieren von UV Licht ein Grund, warum man nicht direkt in ein Magnesiumfeuer schauen soll.
FOTOS
VIDEO
GEFÄHRDUNGSBEURTEILUNG (GESTIS-STOFFDATENBANK, 2020)
Natriumchlorid (Kein gefährlicher Stoff nach GHS)
Kaliumchlorid (Kein gefährlicher Stoff nach GHS)